2010/01/26号◆特別リポート「肺癌治療の進展が期待される試験の数々」
同号原文|
NCI Cancer Bulletin2010年1月26日号(Volume 7 / Number 2)
〜日経BP「癌Experts」にもPDF掲載中〜
____________________
◇◆◇ 特別リポート ◇◆◇
肺癌治療の進展が期待される試験の数々
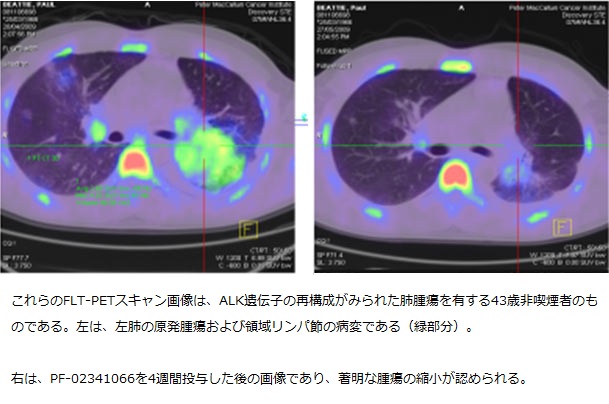
2つの早期臨床試験の結果から、進行肺癌の患者の生存率を改善する新たな治療選択肢の可能性が示唆された。この試験結果は『肺癌における分子的起源に関するAACR-IASLC合同会議(AACR-IASLCJoint Conference on Molecular Origins of Lung Cancer)』(カリフォルニア州コロナード開催)において先ごろ報告された。
肺癌治療の第一人者であるコロラド大学のDr. Paul Bunn氏は、今回の所見は、現在ある肺がん治療の進展の明るい兆しの一つであると述べている。同氏は会見の場で「肺癌患者の生存率を改善する新たな薬剤が、毎年のように生まれています。しかし、まだ先は長いでしょう」と語った。
このうち大規模な試験は、未治療の非小細胞肺癌(NSCLC)患者100人以上を対象とした第2相試験である。患者は、試験対象の標的薬vadimezan[バディメザン](ASA404)の2段階の用量のいずれかと化学療法の併用、または化学療法単独に無作為に割り付けられた。併用治療を受けた患者では、化学療法単独の患者に比べて全生存率が改善していた。また、扁平上皮癌は、非扁平上皮癌に比べて一般に治療が困難であるが、併用療法を行った患者の生存期間中央値が10.2カ月、化学療法単独では5.5カ月であった。
重篤な副作用については、vadimezanを化学療法と併用した患者と化学療法単独の患者の間に有意差は認められなかったと本試験の試験責任医師であるニュージーランドのオークランド大学のDr. Mark McKeage氏は報告している。
Vadimezanは、腫瘍の血管系を攻撃することにより作用するが、血管新生阻害剤とは作用機序が異なる。ベバシズマブ(アバスチン)のような薬剤は、主に腫瘍に向う新たな血管の成長を停止させることにより作用する。一方、vadimezanは、すでに腫瘍に栄養を与えている血管を崩壊させ、腫瘍内の細胞の死滅を促進することから「血管破壊薬」と呼ばれている。
第2相試験の結果は、「きわめて有望」であり、製薬会社ノバルティスファーマが実施している進行NSCLC患者に対するvadimezanの第3相試験の妥当性を裏づけるものであると、デューク大学総合がんセンターのDr. Neal Ready氏は述べた(同氏はこのいずれの試験にも関与していない)。しかし、一方で、特に扁平上皮癌患者の治療で問題となることが多いような重篤な毒性に関しては、さらに大規模な試験を行った場合、今回の第2相試験の結果が再現されることを保証するものではないとも述べている。
学術機関の医療施設で実施される小規模な試験には「大規模な第3相試験に参加する患者に比べ、若く健康な患者が集まる」ことが多いとReady氏は説明し、「そのため、第2相試験では確認できなかった毒性が認められる場合があります。われわれは、特に扁平上皮癌の患者のために、より優れた治療選択肢を求めていますが、第3相試験の結果を待たなくてはなりません」と述べた。
この他の試験としては、約3年前に開始された第1相試験があり、ALKとcMETという2つの遺伝子を標的とする試験段階の治療薬PF-02341066を検証している。当初この試験は、最大耐量を明らかにするため多種の腫瘍の患者を対象としていた。しかし、前臨床の研究から、薬剤に対する感受性の増加に特定の分子マーカーが関与していることを示唆する結果が得られたため、試験責任医師らは、ALKと他の遺伝子との融合あるいは再構成など、特異的な分子的特徴を有する肺腫瘍の患者を拡大コホートとして追加した。2007年には、ある試験によりNSCLCのごく一部にALKとEML4遺伝子の再構成が認められることが報告され、さらに研究が進められた結果、遺伝子異常自体が腫瘍の成長を加速させることが明らかになった。
AACR-IASLC合同会議でコロラド大学のDr. Ross Camidge氏は、腫瘍にEML4-ALKの再構成が確認された患者31人に、PF-02341066を投与したデータを報告した。一部の患者には完全な腫瘍の消失が認められ、奏効(腫瘍の縮小)率は65%であった。試験に参加した患者の約2/3には、すでに2種類以上の治療レジメンが実施されていた。
Camidge氏の説明によれば、NSCLC腫瘍のなかには、ALK遺伝子の活性化および腫瘍増殖の促進に、ALKと他の遺伝子(大半はEML4であるが、他の融合も同定された)との融合を必要とするものがあるという。ALKが関与する再構成はNSCLC患者の3〜6%で確認されており、特に非喫煙者や軽度の喫煙者、および肺腺癌の患者に認められる傾向があった。
Camidge氏は、この試験は「臨床現場の研究者が製薬会社と緊密な協力関係を築き、柔軟で迅速な対応をした素晴らしい事例です。小規模な試験であったため、遺伝子の再構成について新たに得られたデータに対して、研究者が迅速に対応できたのです」と述べた。
この試験(進行中の試験に加えて、当初の計画通りcMET遺伝子の過剰発現がみられる腫瘍を有する患者の拡大コホートを含む)では、状況に応じた変更が行われたが、これは臨床試験実施における重要な転換の代表例である、とシカゴ大学の試験分担医師であるDr. Ravi Salgia氏は語った。
さらにSalgia氏は「これは新たなパラダイムを構築します。早い段階で、われわれは、ある薬剤に最も適した対象患者を特定するための腫瘍の分子学的な特徴を入手し、迅速に医療の現場へ情報を反映させることになります」と述べた。「イマチニブのときとよく似ています。実験室での成果を迅速に臨床へ反映させる、逆もまた然りです」。
製薬会社であるファイザーは、EML4-ALK再構成がみられる腫瘍を有する患者のみを対象に、すでに第3相試験を開始している。
ヴァンダービルト・イングラムがんセンターのDr. David Carbone氏は、ALK再構成に関するデータに加えて、NSCLC患者のEGFR遺伝子変異によりエルロチニブ(タルセバ)への反応が予測可能であることを示した過去の所見を指摘し、このような変異の検査が、肺癌患者には「標準治療の一部」となるべき段階に来ていると述べた。
また同氏は会見の場で、「今や肺腺癌患者の大半に通常の検査として腫瘍の遺伝子検査を行う必要があることは明らかです。臨床的な特徴では、これらの患者を同定することができません。これを可能にするのは変異の検査であり、このような薬剤は今後ますます増えていくでしょう」と述べた。
アボットは、PF-02341066治療の有効性を高める可能性が高いと考えられる遺伝子再構成について、これを有する患者をスクリーニングする「companion diagnostic(コンパニオン診断:治療薬の選定を目的とした検査)」を開発するためファイザーと共同研究を行っている。
—Carmen Phillips
******
波多野 淳子 訳
後藤 悌(呼吸器内科医/東京大学大学院)監修
******
【免責事項】
当サイトの記事は情報提供を目的として掲載しています。
翻訳内容や治療を特定の人に推奨または保証するものではありません。
ボランティア翻訳ならびに自動翻訳による誤訳により発生した結果について一切責任はとれません。
ご自身の疾患に適用されるかどうかは必ず主治医にご相談ください。
肺がんに関連する記事
米FDAがニボルマブ+ヒアルロニダーゼ-nvhy皮下注を承認
2025年2月3日
処方薬+カウンセリングの統合ケアにより禁煙成功率が上昇
2025年1月23日
医療従事者への共感研修で肺がんへの偏見をなくす
2025年1月22日
米FDAがALK陽性局所進行/転移非小細胞肺がんにensartinibを承認
2025年1月25日



