2010/05/04号◆特集記事「FDAが初の癌治療ワクチンを承認」
同号原文|
NCI Cancer Bulletin2010年5月4日号(Volume 7 / Number 9)
〜日経BP「癌Experts」にもPDF掲載中〜
PDFはこちらからpicture_as_pdf
____________________
◇◆◇ 特集記事 ◇◆◇
FDAが初の癌治療ワクチンを承認
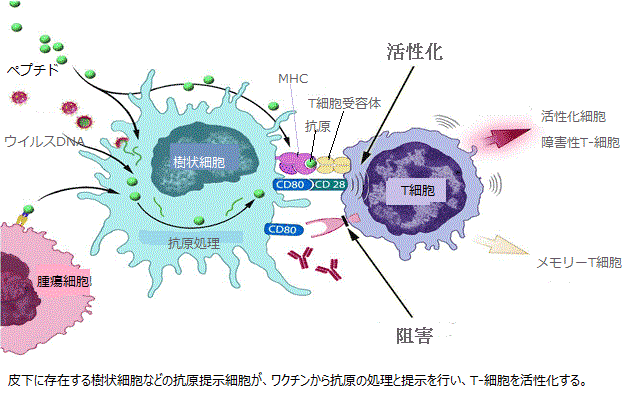
先週FDA が初の癌治療ワクチンsipuleucel-T[シプリューセル-T](Provenge[プロベンジ])を承認したことにより、癌免疫療法の分野は大きな進歩を遂げた。同ワクチンは、プラセボワクチンと比較して全生存期間の中央値が4カ月以上改善したことを示す第3相ランダム化試験(IMPACT)の結果に基づいて、一部の転移性前立腺癌男性を対象として承認された。しかし、ワクチン製造の問題で、少なくとも今後12カ月間はワクチンの供給は極めて制限されたものになる。
FDAによる同ワクチンの承認はいくつかの段階で重要である。こう述べたのは、ダナファーバー癌研究所のLank Center for Genitourinary Oncology所長でIMPACT試験の責任医師を務めるDr. Phillip Kantoff氏である。同氏はさらに「今回の承認によって、免疫療法が癌治療として奏効し、癌全般でもうまくいく可能性があるという原理が初めて証明されたことになります。研究者が本試験結果を足場として他の治療戦略と共に向上させていく機会と見なすことを期待します」と述べた。
またKantoff氏によると臨床的観点からは、進行前立腺癌を有する多くの男性のうちホルモン治療に反応しなくなった(ホルモン抵抗性または去勢抵抗性癌としばしば呼ばれる)患者は、比較的毒性のない新しい治療選択肢を得られることになる。このような患者に対する唯一の承認薬は化学療法剤のドセタキセル(タキソテール)であるが、生存期間の改善は平均2.4カ月である。同氏は、「患者はこのワクチンによって意味のあるベネフィットを得られます。もちろん、癌の治癒ではありませんが、重大な臨床上の利益です」と述べた。
FDAは、無症候性または軽度の症状をもつ転移性去勢抵抗性前立腺癌患者500人以上を登録したIMPACT試験に対し、sipuleucel-T承認への支援を要請した。全生存率が主要評価項目であった。3月の米国臨床腫瘍学会(ASCO)生殖泌尿器癌シンポジウムで報告された最新の臨床試験結果によると、sipuleucel-Tにより3年生存率の中央値がプラセボと比較して40%近く改善し(32.1%対23%)、全生存期間の中央値も4.1カ月延長した(25.8カ月対21.7カ月)。これらの結果は論文審査のある専門誌にはまだ掲載されていない。
前立腺癌に対するさまざまな治療ワクチンの臨床試験のいくつかを主導したNCI癌研究センターのDr. James Gulley氏によると(枠囲記事を参照のこと)、本承認は、免疫療法などの積極的治療法の概念を正当化するものであるという。免疫治療は癌細胞を攻撃するように免疫系を教育し、効果を得ることを意図しており、その反応は「今後数カ月または数年間持続しうる」。
本承認や数十年間にわたる研究にもかかわらず、Gulley氏は免疫療法がいまだに発展途上であると認識している。「われわれは、効力が十分なワクチンをいかに開発するか、最も適格な患者集団がどのようなものであるか、および他の治療法との併用によってワクチンをどのように強化するかについて、現在研究を行っている段階です」と同氏は述べた。
異なるパラダイム
FDAの決定によって、sipuleucel-Tおよびその開発会社であるDendreon社(シアトル)にとっていく分混沌としていた15年間の歴史に終止符がうたれた。
FDAは2007年、2件の小規模なランダム化第3相試験の結果に基づいて同ワクチンの承認申請を却下した。これらの試験では、免疫刺激治療でも全生存率のわずかな改善が認められたが、腫瘍が増殖することなく生存率が改善する(無増悪生存期間)という主要評価項目を満たさなかった。この当初の決定において、FDAは細胞・組織・遺伝子治療諮問委員会(Cellular, Tissue, and Gene Therapies Advisory Committee)による承認勧告に従わず、前立腺癌支援団体の人々など多方面から非難を受けた。
免疫療法とそれ以外の癌治療法との真の違いが分かったのは、あのときsipuleucel-Tが承認されなかったことがきっかけだったと、免疫療法研究者でありジョンス・ホプキンス大学シドニー・キンメル総合がんセンターにて前立腺癌集学治療クリニックの副所長を務めるDr. Charles Drake氏は話した。
同氏はさらに、「免疫療法に関してこれまでに得られたデータから、免疫療法によって患者の体内で新たなバランスが作られることが示唆されます。ワクチンの補助を受け、免疫系は腫瘍の増殖を抑制します。死んでいく腫瘍細胞もあるでしょうが、多くの腫瘍は増殖するためにさらに激しく戦わなければならななくなり、免疫系は腫瘍を抑制し続けるために闘う能力がさらに高くなります」と説明した。
その他の開発中治療用癌ワクチンと異なり、sipuleucel-Tは患者ごとに製造される。患者は治療の数日前に、血液から抗原提示細胞(APC)を分離するために白血球アフェレーシスと呼ばれる処置を受ける。このAPCには、樹状細胞やマクロファージなどが含まれるが、これらの細胞は他の免疫細胞によって認識されて免疫反応を引き起こすマーカー(すなわち抗原)を細胞表面上に「提示」している。
APCはDendreon社の施設に送付され、同社が独自に開発したタンパク質と共に培養される。最終的に作成されるのは、大半の前立腺癌細胞に認められる抗原(前立腺酸性フォスファターゼ:PAP)を取り込んだ何億もの「活性型」APCからなるワクチンである。このワクチンは、患者の担当医に戻され、患者に投与される。その目的は、PAPを発現する腫瘍細胞を抑制するために強力な免疫細胞(T細胞)を賦活化することである。患者は、4〜6週間の治療コースにわたって3回の投与を受けるが、各投与毎に同様の製造工程が必要となる。
当初の課題
Dendreon社によると、当初、本ワクチンの製造要件が患者への効果を限定することになるであろうと考えられていた。現在、同社の認可を得た製造工場はニュージャージー州にある1施設のみであり、25%の稼働率で製造している。Dendreon社CEOのDr. Mitch Gold氏が電話での説明で述べたところによると、ジョージア州とカリフォルニア州にそれぞれある2つの製造工場は2011年半ばまでに完成して本ワクチンの製造認可をFDAから受ける予定である。このことは、今後12カ月間は「需要が供給を上回る」ことを意味する。
同社社員の説明では今後1年間は、sipuleucel-T臨床試験の承認施設である腫瘍科および泌尿器科の医療機関50施設にて、同剤を用いた治療が約2,000人の患者に対して施行可能である。3回の治療コースの費用は93,000ドルであり、民間保険会社やメディケア(公的保険)で保障されると同社は期待している。
また、本ワクチンの最適な使用方法については疑問がある。Drake氏の説明によると、IMPACT試験では、sipuleucel-T投与終了後に追加治療(すなわちドセタキセル)を実施する根拠となる疾患進行を判定するため予め設定した項目がなかった。患者に多くの症状が現れるまでドセタキセルを投与しなかった場合もあった一方、ワクチン投与終了後すぐにドセタキセルを投与した場合もあった。
Drake氏は、「副作用の観点、または明らかな腫瘍縮小や前立腺特異抗原の減少を引き起こす観点で、本剤は従来の化学療法剤とは異なります。したがって、どの時点で次の段階(すなわち化学療法や臨床試験)へ移行するべきであるか、正直なところ、まだ答えは得られていません」と述べた。
Sipuleucel-Tは、早期の非転移性前立腺癌を有する男性を対象とするPROTECTと呼ばれる第3相試験などのいくつかの臨床試験で評価されている。初期段階の疾患は免疫療法にとって最適な状況であると免疫治療分野の研究者らは考えている。
Drake氏は、「承認を得たことで、これらの試験を開始することができました」と強調し、「承認されたことによって、他の治療法との併用でワクチンを使用することもできます。動物モデルでは、免疫療法は他の治療法と少なくとも相加的であり、時には相乗的でありうるため、今回の承認は、より早く併用を試みる足がかりになる」と述べた。
— Carmen Phillips
| もう1つのワクチン、異なるアプローチ |
| NCIの研究者であるDr. Gulley氏とDr. Jeffrey Schlom氏は、Prostvacと呼ばれるもう1つの前立腺癌ワクチンの開発を主導している。Prostvacは2010年後半に開始予定の国際共同第3相試験で評価されることになっている。FDAは先週、同剤をファストトラック指定とした。これは、開発および規制当局の審査を迅速化させるための動きである。2件の独立した第2相ランダム化試験によると、sipuleucel-Tと同様にProstvacによって全生存率が改善したが、無増悪生存期間は延長しなかった。症状の軽度な転移性去勢抵抗性前立腺癌患者を対象としたKantoff氏の主導する最新試験では、同治療ワクチンによって全生存期間の中央値がプラセボワクチンよりも8.5カ月延長した。 Prostvacは、NCIとの共同研究および開発協力の一部としてドイツのBavarian Nordic社から販売されており、sipuleucel-Tとは異なり、従来型の「既製の」治療薬である。こう説明するのは、さらに大規模な第3相試験で試験責任医師を務める予定のGulley氏である。 Prostavacでは、免疫系を刺激することが知られている他の分子と共に送達媒体(ベクター)として2つのウイルスが使用される。各ウイルスベクターは、前立腺癌細胞によく認められる前立腺特異抗原(PSA)を搭載している。したがって、本ワクチンは、共刺激分子とともに投与される異なる2つのウイルスベクターである。1つ目はvaccinia-PSA-TRICOMであり、注射で1回投与し、免疫系を刺激して抗癌反応を起こさせる。もう1つはfowlpox-PSA-TRICOMであり、注射で数回投与され、繰り返し免疫系を活性化させる。 |
******
斉藤 芳子 訳
榎本 裕 (泌尿器科医)監修
******
【免責事項】
当サイトの記事は情報提供を目的として掲載しています。
翻訳内容や治療を特定の人に推奨または保証するものではありません。
ボランティア翻訳ならびに自動翻訳による誤訳により発生した結果について一切責任はとれません。
ご自身の疾患に適用されるかどうかは必ず主治医にご相談ください。
前立腺がんに関連する記事
高リスク前立腺がんの治療ー放射線か手術か
2025年9月24日
今回報告された研究ではその疑問を明...
【AACR2025】 オラパリブ+ペムブロリズマブ併用は、分子マッチングによる臓器横断的試験で有望な結果
2025年7月18日
【ASCO2025】年次総会注目すべき追加研究・LBA ②
2025年7月18日
エンザルタミドは進行前立腺がんの生存期間を延長
2025年6月17日





