CAR-T細胞:患者の免疫細胞を遺伝子操作してがんを治療する
米国国立がん研究所(NCI)
何年もの間、がん治療の基本は外科手術、化学療法、放射線療法であった。ここ20年の間に、イマチニブ(グリベック)やトラスツズマブ(ハーセプチン)などの分子標的薬治療薬(主にがん細胞内に存在する特定の分子変化を狙い撃つことでがん細胞を標的とする薬剤)も、多くのがんの標準療法としての地位を固めてきた。
しかし、ここ数年、免疫療法(患者の免疫系の力を利用・強化して腫瘍を攻撃させる治療法)が出現し、腫瘍学界の多くの人々にがん治療の「5つ目の柱」と呼ばれている。
養子細胞移入療法(ACT)と呼ばれる免疫療法が、急速に出現してきた。この治療法は患者の免疫細胞を採取・利用してがん治療に用いる。ACTの種類は数種類(下部枠囲「ACT:TIL、TCR、CAR」を参照のこと)あるものの、今のところ、臨床開発が最も進んだACTはCAR-T細胞免疫療法と呼ばれている。
最近まで、CAR-T細胞免疫療法は主に重度の血液がん患者を主に対象とした小規模臨床試験での利用に限られていた。それにもかかわらず、これらの治療法は研究者ならびに一般人の関心を集めた。これは、CAR-T細胞免疫療法以外の治療法が奏効しない患者の中にめざましい奏効を示す患者(小児と成人の両方で)が居たからである。
2017年、CAR-T細胞免疫療法は米国食品医薬品局(FDA)の承認を受けた。急性リンパ芽球性白血病(ALL)小児患者に対する治療法および進行したリンパ腫成人患者に対する治療法としてである。それにもかかわらず、研究者らは多くの側面から、CAR-T細胞とそれ以外の養子細胞移入療法(ACT)を用いた治療はまだ草創期であると注意を促している。たとえば「乳がんや大腸がん等の固形がんに対して有効か否か」などの疑問を呈している。
異なる種類の養子細胞移入療法(ACT)が「次々と開発中です」、とNCIがん研究センター(CCR)の外科部門長である Steven Rosenberg[スティーブン・ローゼンバーグ]医学博士は述べた。ローゼンバーグ医学博士は免疫療法のパイオニアであり、同氏の研究室がCAR-T細胞を用いたがん治療(PubMed)に初成功した。
しかし、数十年に渡る骨の折れる研究の後、ついにこの研究分野に転換点が訪れた、とローゼンバーグ医学博士は続けた。わずかここ数年の間で、CAR-T細胞とそれ以外の養子細胞移入療法(ACT)を用いた治療法の進歩は大幅に加速した。研究者らは、患者でこれらの治療法が作用する機序をさらに理解した。また、そこから得た知識を治療法についての開発方法や検査方法の改善につなげている。
「今後数年の間にCAR-T細胞とそれ以外のACTを用いた治療法に劇的な進歩がみられると思います。この進歩により、これらの養子細胞移入療法を元にした治療法でできることが増えるでしょう。」
目次
・「生きた薬」
・これまで選択肢がなかったところへの、ひとつの可能な選択肢
・副作用を理解・管理する
・CAR-T細胞の標的となる新たな抗原
・CAR-T細胞の適応は固形がんにも拡大するか?
・CAR-T細胞療法の進展
「生きた薬」
CAR-T細胞は「患者に生きた薬を投与すること」とほぼ同じ意味を持つ、とスローンケタリング記念がんセンター(ニューヨーク州)のRenier J. Brentjens医学博士は説明する。Brentjens医学博士はCAR-T細胞研究草創期を率いたもう1人の貢献者である。
CAR-T細胞という名称が示す通り、CAR-T細胞療法はT細胞をベースにしている。T細胞は、免疫系の組織化および病原菌に感染した細胞の殺傷において重要な役割を果たす。このために「免疫系の馬車馬」としばしば呼ばれている。CAR-T細胞療法では、患者の血液を採血し、その中からT細胞を分離する。次に、無害化したウィルスを用いてT細胞を遺伝子組換えし、細胞表面にキメラ抗原受容体(CAR)と呼ばれる受容体を産生する。
CARは「合成分子であり、本来は存在しない」、と、米国国立衛生研究所(NIH)で最近行われたCAR-T細胞に関する発表中にペンシルベニア大学 エイブラムソンがん センターのCarl June医師は説明した。June医師は主に白血病患者を対象とした一連のCAR-T細胞臨床試験を主導している。
これらの合成された受容体により、腫瘍細胞上の特定のタンパク質、つまり抗原をT細胞は認識・結合できるのだ。さらに開発中のCAR-T細胞療法はCD19(「CAR T細胞の作成方法」参照のこと)と呼ばれるB細胞上に認められる抗原を標的にする。
ひとたび回収されたT細胞は遺伝子操作を受け抗原特異的CARを発現する。この抗原特異的CARは研究室で「増殖」され、何億倍にもなる。
最終段階では、CAR-T細胞を患者に注入する(「リンパ球枯渇」化学療法レジメンを先行して行う)。全てが予定通りに進めば、この加工された細胞は患者の体内でさらに増殖する。そして、加工された受容体の指示に従って、細胞表面上に抗原を提示しているがん細胞を認識・死滅させる。
これまで選択肢がなかったところへの、ひとつの可能な選択肢
CAR-T細胞免疫療法開発は、当初主に急性リンパ芽球性白血病(ALL)を対象に行われていた。ALLは小児で最も頻繁に認められるがんである。
B細胞に生じるALL(小児ALLで最も多い種類)の診断を受けた小児患者の80%以上は強化化学療法により治癒する。しかし、化学療法あるいは幹細胞移植を受けた後にがんが再発した患者には、治療選択肢が「ほとんどない」、とフィラデルフィア小児病院(CHOP)のStephan Grupp医学博士は述べた。
実際のところ、再発ALLは小児がんの主な死因となっている。
Grupp医学博士は、再発した、あるいは既存の治療法が奏功しないALL小児および若年成人患者を対象としたCAR-T細胞に関する試験を数回主導してきた。これまでに行われた試験のうちの1つでは、CD19標的CAR-T細胞を利用した。この試験で治療を行った患者30人中27人でがんの徴候が全て消滅した(完全奏効)。治療終了後長期間経過後も患者の多くからは再発の徴候が依然として認められなかった。
こういったこれまでの研究の成功により、CD19標的CAR-T細胞に関するより大規模試験が行われるに至った。この大規模試験で用いられたCD19標的CAR-T細胞免疫療法は、チサゲンレクロイセル(Kymriah[キムリア])と呼ばれ、ALLに罹患した小児および若年成人患者を対象としている。この試験はノバルティス社の助成金を受けた。試験に参加した患者の多くは完全寛解あるいは長期間にわたる寛解を示した。この結果に基づき、FDAは2017年8月にtisagenlecleucel[ゲンレクロイセル]を承認した(*FDA「米国初の遺伝子治療(CAR-T療法)薬tisagenlecleucelをFDAが承認」。
CCRの小児腫瘍科(POB)の研究チーム主導のCD19標的CAR-T細胞に関する試験が複数行われたが、その試験でも同様の結果が得られた。
この進歩によりALL小児患者においてCAR-T細胞免疫療法が現在にいたるまで「素晴らしい選択肢となっているのです」と、CAR-T細胞に関する数回行われたPOB試験の試験責任者であるTerry Fry医師は述べた。当初、CD19標的CAR-T細胞の試験は成人を対象に実施されたしかし、CAR-T細胞免疫療法の初承認がALL小児および若年成人患者に対する治療法としての承認であったことは転換期であった、とFry医師は続けた。
CAR-T療法は小児を対象とした新規治療法として成人よりも先に承認されたが、このようなことは「がん領域においてほぼ前例がありません」と述べる。
しかし、成人血液がん患者の治療に用いられたCAR-T細胞に関するデータも劣らず有望なものであった。CD19標的CAR-T細胞を用いた利用に関し、ALL患者のみならず悪性リンパ腫患者でも有望な結果が認められた。たとえば、CAR-T細胞に関するNCI主導の小規模試験では進行したびまん性大細胞型B細胞リンパ腫患者を対象としたが、その患者の半数以上が治療に対して完全奏効を示した。
「現時点では事実上治療不可能なリンパ腫もあるが、当試験データからCAR-T細胞の真の可能性が初めて垣間見えました」、と試験責任者でNCIの実験移植学/免疫学部門の James Kochenderfer医師は述べた。
この頃より、Kite Pharmaceuticals社(同社はNCIとACTを利用した治療法の開発に関し契約を結んでいる)の資金提供を受けた大規模試験の知見によりこれまでの結果が実証され、Kite社のCAR-T細胞製品であるaxicabtagene ciloleucel(商品名:Yescarta[イエスカルタ])が一部のリンパ腫患者に対しFDAの承認を受ける基礎となった(*FDAニュース「FDAがCAR-T細胞療法Yescartaを成人大細胞型B細胞リンパ腫に承認」。
今までのところ、悪性リンパ腫に関するこの大規模試験は「信じられないほど成功していて、CAR-T細胞を用いた治療法が数種の悪性リンパ腫に対して頻繁に用いられることはほぼ確かです」、とKochenderfer医師は述べた。
CAR-T細胞の可能性を早期の段階で信じていた人でさえCAR-T細胞免疫療法の急激な進歩と拡大は予想外であった。
「CAR-T細胞を用いた治療法に効果があると考えていただろうか?えぇ!そう思っていましたとも!」と、Brentjens博士は述べた。しかし、CAR-T細胞免疫療法は当初「小規模専門店型の治療法」と考えられており、極めて少数の限られた患者にのみ適用されていた。バイオ医薬品業界のCAR-T細胞免疫療法領域への参入など、過去5年間の経験によりBrentjens博士の見通しが変わった。
「末期と考えられていた患者集団が、いまや持続的で意味のある寛解を得ており、良好なQOL期間は最大5年にもなっているのです」、とBrentjens博士は続けた。「ですので、CAR-T細胞免疫療法に対する熱意が最近では極めて高くなっています」。
副作用を理解・管理する
全てのがん治療と同様に、CAR-T細胞免疫療法は厄介で、時として致命的な副作用が複数伴う。もっとも高頻度に認められる副作用の1つがサイトカイン放出症候群(CRS)である。
T細胞は免疫に関わる作用を有する。その作用の一環としてサイトカインという化学物質伝達物を放出する。サイトカインは免疫応答の促進・指揮を司る。サイトカイン放出症候群を発症した場合、血中に大量のサイトカインが急激に放出される。この急激な放出は、危険になりうる高熱を引き起こし、血圧の急降下を招く。
皮肉なことに、サイトカイン放出症候群はCAR-T細胞免疫療法が「的確に」作用したことの効果と考えられている。つまり、サイトカイン放出症候群が発症することはT 細胞が活性化し体内で作用している証拠なのだ。一般に、CAR-T細胞投与を受ける前の段階で疾患が極めて広範囲に及ぶ患者が重度のサイトカイン放出症候群を発症する、とKochenderfer医師は説明した。
小児と成人患者の療法で、サイトカイン放出症候群はステロイドなどの一般的な支持療法で管理できる場合が多い。研究者がCAR-T細胞免疫療法に関する経験を積むにつれ、より重症なサイトカイン放出症候群症例をこれまでよりも上手く管理する方法を身に着けている。
たとえば、数年前、CHOPの研究チームは重篤なサイトカイン放出症候群を呈する患者のIL-6濃度が極めて高いことを発見した。IL-6は炎症に反応してT 細胞とマクロファージが分泌するサイトカインである。その結果、研究チームは若年性関節炎などの炎症性疾患に対し承認済みの治療薬に注目した。たとえば、トシリズマブ(商品名:アクテムラ)などだ。トリシズマブはIL-6の活性を阻害する。
この取り組みは成功し、多くの患者でこの問題が急速に解決されるに至った。このころより、トシリズマブは重篤なサイトカイン放出症候群の管理における標準治療薬となった。
ノバルティス社のCD19標的CAR-T細胞に関するFDA専門家諮問委員会のミーティング中に、「(サイトカイン放出症候群の)等級付けについても、その治療法についてももうわかっていますと、Grupp博士は述べた。「また、IL-6の阻害が本当に重要なのです」とも述べた。
サイトカイン放出症候群以外でCAR-T細胞免疫療法で起こりうる副作用(標的外の効果)はB細胞が大量に死滅するという現象だ。この現象はB細胞形成不全として知られる。また、CD19は正常なB細胞にも発現する。B細胞は病原菌を死滅させるための抗体の産生を担う。これらの正常なB細胞は注入投与されたCAR-T細胞によっても殺されることが多い。これを代償するために、免疫グロブリン療法を受ける患者が多い。免疫グロブリンは炎症に対抗するために必要となる抗体を産生する。
さらに最近では、進行した白血病患者に対するCAR-T細胞免疫療法についてFDAの承認が下りる可能性がある。その可能性を後押しするためにより大規模な試験が行われている。その一部の試験で、サイトカイン放出症候群とB細胞形成不全以外でも重篤で致死的となりうる副作用である脳浮腫が認められている。事実、複数の臨床試験で治療に起因する脳浮腫の結果、複数の患者が死亡した。そういった死亡事象が発生した後、ある企業は実際、進行中のCAR-T細胞免疫療法の開発を停止した。
しかし、脳浮腫といった副作用問題は限定的であり、CAR-T細胞免疫療法に関する他の試験の主導者からは脳浮腫の事例が報告されていない。
また、脳浮腫以外のいわゆる神経毒性(精神錯乱や痙攣発作様の現象)が多くのCAR-T細胞免疫療法に関する試験で認められている。しかし、大半の患者では、こういった問題は短期間しか続かず、可逆的である、とBrentjens博士は述べた。
早期の段階より、「これらの神経毒性はサイトカイン放出症候群に関連しているのでは」といった推測がなされていた。しかし、研究者らは神経毒性の機序の理解について協力しているものの、神経毒性がサイトカイン放出症候群に由来していることが明らかである点について、「この研究領域の研究者の大半が合意していると考えています」、とBrentjens博士は付け加えた。
画像2:
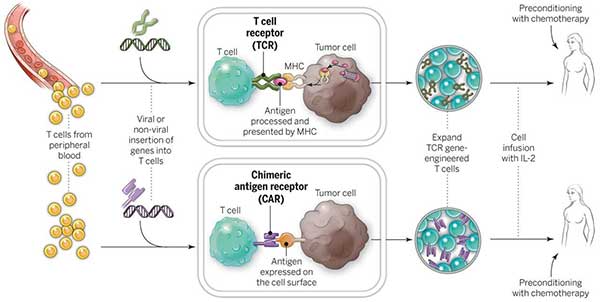
【図解説】CAR-T細胞とTCR-T細胞とは自身の表面上に特殊な受容体を産生するように加工される。そして、CAR-T細胞とTCR-T細胞は研究室で増殖され患者の体内に戻される。
CAR-T細胞の標的となる新たな抗原
CAR-T細胞に関する研究は依然として続けられており、その対象患者はほとんどが血液がん患者である。しかし、固形がん患者も対象としている。バイオ医薬品業界のCAR-T細胞への関与が深まった。例えば、CAR-T細胞の検証を行う臨床試験数が劇的に増え、5年前には一握り程の研究数であったのが180件となり、現在でもその試験数が増え続けている。
現在までに行われた試験の大半ではCD19標的CAR-T細胞を利用している。しかし、この状況も素早い変化を遂げている。これは一部には必要に迫られたものだ。
たとえば、ALL患者の中にはCD19標的CAR-T細胞を用いた治療法に反応しない者もいる。そして、完全寛解を得た患者でも最大1/3の患者が1年以内に疾患が再発するのだ、とFry医師は述べた。こういった疾患再発の多くはもうCD19を発現していないALL細胞に関連している。ALL細胞がCD19を発現しなくなった状態は抗原欠損として知られている。
したがって、進行したALL小児患者および若年成人患者を対象に、NCIのPOB研究チームはCD22を標的とするCAR-T細胞に関して検証した。CD22もALL細胞が過剰発現することが多い。CD22標的CAR-T細胞に関し、初めて実施された試験では治療を受けた患者の大半が完全寛解を示した。その中にはCD19標的CAR-T細胞を用いた治療法による初回治療を受けた後に完全寛解を示したのちにがんが進行した患者もいる。
しかしCD22標的CAR-T細胞を用いた治療法も、CD19標的と同じように、治療後がんが再発することはめずらしくない、とFry医師は説明した。
「持続的な寛解という観点から言えば絶対的に改善の余地があります」と、Fry医師は述べた。
持続的な寛解の改善、そしてもし、抗原欠損を完全に防ぐことができないならば、少なくともそれを未然に防ぐためにできる可能性がある方法の1つに同時に複数の抗原を攻撃する、というものがある。たとえば、複数の研究グループはCD19およびCD22の両方を標的とするT細胞を初期段階の臨床試験で検証している。
CHOPの研究グループも、CD19およびCD123の両方を標的とするCAR-T細胞を検証中である。CD123はCD22以外に白血病細胞中でよく認められる抗原である。動物モデルを用いた早期試験から、この様に2種類の抗原を標的化することにより抗原欠損が予防できる可能性があることが示唆された。
CAR-T細胞免疫療法の抗原標的は白血球以外の血液がんでも確認された。たとえば多発性骨髄腫である。
NCIのKochenderfer医師の研究チームは、Kite社との共同研究の一環として、BCMAタンパクを標的とするCAR-T細胞を開発した。BCMAタンパクはほとんどすべての骨髄腫細胞に認められる。
進行した多発性骨髄腫患者を対象としたBCMH標的CAR-T細胞に関する初期段階の臨床試験では、患者の半数以上が治療に対して完全奏効を示した。Kite社は、現在、BCMA標的T細胞をより多くの患者で検証する試験に着手している。
CAR-T細胞の適応は固形がんにも拡大するか?
CAR-T細胞による治療は固形がんでも同様に成功を収めるかについては多少疑問の余地がある。ローゼンバーグ博士は、固形腫瘍上の標的に適した抗原を見つけることは、これまでも重要な課題であった。この抗原を見つけるという課題が大半の症例で非常に難しいと判明したとみていた。
「固形がんの表面上にある特異な抗原を特定する試みはほとんどが不成功に終わっています」と、ローゼンバーグ博士は述べた。
研究者らは、圧倒的多数の腫瘍抗原は腫瘍細胞内に存在し、細胞表面上の抗原にのみ結合できるCARには手の届かないところにあると推測している。
その結果、メラノーマですでに示された通り、CAR以外の種類の養子細胞移植(ACT)の方が固形腫瘍に適していると確信している、とRosenberg博士は述べた。
しかし、研究者らがCAR-T細胞についての検証を行っていないということではない。
たとえば、研究者らはメソセリンやEGFRvIIIというタンパク質を標的とするCAR-T細胞に関する試験を実施している。メソセリンは膵臓がんや肺がんなどの非常に致死性の高いがんの一部に認められる腫瘍細胞上に過剰発現しているタンパクである。EGFRvIIIは、高悪性度の脳腫瘍である膠芽腫患者のほぼすべての腫瘍細胞で認められるタンパクである。
しかし、これらの試験の早期報告かは血液がんで得られたものと同様の成功は報告されていない。
「CD19と同様の方法で固形がん上の抗原を標的とする限り、ほとんどの症例で効果がでたと思えません」と、Brentjens博士は認めた。
固形がんに関してのもう1つの重要な障害がある。それは、固形がんを取り巻く微小環境の構成因子が相互的に働いて免疫応答を鈍化させることであると、Brentjens博士は説明した。
したがって、固形腫瘍に対して成功を収めるには「スーパーT細胞」が必要となる可能性がある。「スーパーT細胞」とは多くの進行した固形腫瘍の免疫を抑制する環境を克服するように設計されたT細胞である。これらの性質を有するCAR-T細胞、つまり「武装化した」CAR-T細胞の開発はスローンケタリング記念がんセンターで進行中である、とBrentjens博士は述べた。
CAR-T細胞療法の進展
CAR-T細胞の改良版が現在検証されている。そのうち取り組みの1つに患者由来でなく健康なドナー由来の免疫細胞を用いたCAR-T細胞療法の開発、というものがある。この発想は、「個々の患者に合わせて作る必要がないのですぐに利用できる」という既製のCAR-T細胞療法薬を創る、というものだ。
実際に、フランスのCellectis社が進行した急性骨髄性白血病患者を対象にした既製のCD19標的CAR-T細胞製品に関する第I相試験に着手している。Cellectis社の製品はTALENとして知られる遺伝子編集技術を用いて製造されている。その製品はすでにヨーロッパでは検証を受けている。対象にはCellectis社の製品以外に治療選択肢が残されていないALL幼児患者2人も含まれていた。この2人の両方で治療が奏効した。
Cellectis社以外の既製のCD19標的CAR-T細胞製品についても数多くが検証中である。たとえば、研究者らはナノテクノロジーを利用して体内にCAR-T細胞を作り、「OFFスイッチ」を有するCAR-T細胞を開発している。この「OFFスイッチ」は、サイトカイン放出症候群などの副作用を予防・制限する手段である。また、遺伝子編集技術であるCRISPR/Cas9を用いてT細胞の編集の精度を高めている。
しかし、既存のCAR-T細胞免疫療法に関してやるべきことがまだ残されている、とFry医師は述べた。
ALL小児患者、特に初回化学療法後にALLが再発するリスクの高い(特定の臨床的因子に基づいて判断)患者に対する治療で、より早期の段階でCAR-T細胞を利用する可能性についてFry医師は特に熱心に取り組んでいる。初回化学療法の期間は、通常、約2.5年である。
「より早期の段階でCAR-T細胞を利用する」というアプローチでは、もしこういった高リスク患者の化学療法に対する反応が不良であることが早期の段階で徴候として認められたら、もう化学療法はやめてCAR-T細胞による治療を行えるとFry医師は説明した。
CAR-T細胞を利用した治療に対する反応が良好な患者は、「化学療法を2年以上受けずに済むのです」、とFry医師は述べた。「これは素晴らしいことです。」
~~~~~
コラム1:CAR-T細胞の作り方
CAR-T細胞免疫療法の開発数、および臨床試験で検証されている数がますます増えている。
治療間に大きな違いがあるが、治療を構成する要素は全ての治療でほぼ同じである。細胞表面のCARは合成抗体の断片あるいはドメインで構成されている。この構成要素であるドメインは受容体が腫瘍細胞上の抗原を認識し、結合する方法に影響を及ぼすことができる。
受容体の作用は細胞内部から送られる刺激信号に依存している。したがって、個々のCAR-T細胞には細胞内にシグナル伝達ドメインと「共刺激」ドメインが存在する。こういったドメインが細胞表面受容体から細胞に信号を送っているのだ。各種ドメインが利用されており、細胞の全体的な機能に影響を及ぼしている。
こういったCAR-T細胞の細胞内操作は、経時的に加工されたT細胞の機能を改良する。改良された機能は、T細胞が患者体内に注入された後により多くの細胞を産生する機能(増殖)および血中でより長期間生存する機能(持続性)である。
ひとまとまりのCAR-T細胞を作るのにかかる時間についても改良がなされている。当初数週間かかっていたが、現在、7日未満への短縮に成功した研究室が複数ある。
~~~~~
コラム2:ACT:TIL、TCR、CAR
養子免疫療法(ACT)領域の細胞治療に関して言えば、CAR-T細胞が多大な関心を集めている。しかし、CAR-T細胞以外のACTも小規模試験で有望性を示している。たとえば、固形腫瘍患者を対象とした小規模試験である。
腫瘍浸潤リンパ球(TIL)として知られる腫瘍内外の環境に浸透する免疫細胞を用いる治療法はそのうちの1つである。NCIの研究グループはまず、TILを利用して進行がん患者の治療に成功した。当初はメラノーマの治療、のちに子宮頸がんなどメラノーマ以外の数種類のがんの治療に成功している。がんはそれぞれ特異的な変異を有する。さらに最近では、NCIの研究チームはがん細胞が有するその特異的な変異を認めるTILを特定する技術を開発した。進行性大腸がん患者および進行性肝がん患者でこのTIL特定技術によって腫瘍縮小に至った症例が複数認められた。
TIL特定技術以外のACTに関する主な取り組みの1つに、患者のT細胞を加工して特殊なT細胞受容体(TCR)を発現させる、というものがある。CARでは、合成抗体の複数の部分を利用している。こういった合成抗体の複数の部分は細胞表面上にのみ存在する特定の抗原を認識することができる。一方、TCRでは自然に存在する受容体を利用している。こういった受容体は腫瘍細胞内に存在する抗原も認識することができる。これらの抗原の小片はMHC複合体と呼ばれるタンパク集合体の一部として細胞表面に運ばれ免疫系に「提示」する。
現時点で各種の固形腫瘍を呈する患者でTCR-Tsaibouga 検証されており、メラノーマと肉腫で有望であることが示された。
原文掲載日
【免責事項】
当サイトの記事は情報提供を目的として掲載しています。
翻訳内容や治療を特定の人に推奨または保証するものではありません。
ボランティア翻訳ならびに自動翻訳による誤訳により発生した結果について一切責任はとれません。
ご自身の疾患に適用されるかどうかは必ず主治医にご相談ください。
リンパ腫に関連する記事
抗PD-1抗体抵抗性の悪性リンパ腫にエピジェネティック療法併用が有望
2025年11月10日
CD19 CAR-T細胞療法が最も有益なB細胞リンパ腫の特徴が判明
2025年6月30日
...
米FDAが再発・難治性濾胞性リンパ腫にタファシタマブ-cxixを承認
2025年6月23日
【ASCO2025】年次総会注目すべき追加研究・LBA ①
2025年7月18日





