2010/07/27号◆特別リポート「発展途上にある癌幹細胞の科学」
同号原文|
NCI Cancer Bulletin2010年7月27日号(Volume 7 / Number 15)
〜日経BP「癌Experts」にもPDF掲載中〜
____________________
◇◆◇ 特別リポート ◇◆◇
発展途上にある癌幹細胞の科学
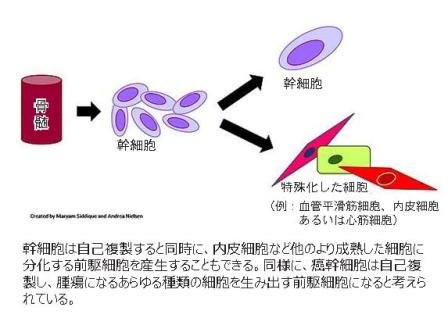
癌幹細胞(CSC)説は、過去10年間でおそらく癌研究のどの領域よりも興奮と希望をもたらした。この学説によれば、生物学的に癌幹細胞とは、腫瘍を形成する大半の細胞とは異なった特殊な細胞であり、従来の幹細胞と同じ方法で自己再生を繰り返しながら前駆細胞を生みだすことができる。ここでの前駆細胞の役割は、化学療法や放射線療法などの治療により根絶された腫瘍細胞を再発させることである。
しかし癌幹細胞研究が注目され、宣伝されたにもかかわらず、今日までに報告された知見は明快なものとは程遠いことを研究者らは認識している。例えば、ヒトの癌幹細胞を同定したという研究のほとんどはマウスへの異種移植試験でごくわずかなヒト腫瘍試料からの細胞を使用しており、はっきりとした結論を引き出すのは困難である。さらに、最初に報告された知見を他の研究者らが常に再現できるわけではない。(補足記事「癌幹細胞研究のツール:マーカーおよび異種移植」参照)。癌幹細胞は癌源細胞(tumor-initiating cell)とも呼ばれ、まれな種類とされているが、いくつかの研究ではマウスの実験において腫瘍を形成することができる細胞は実際に極めて数多く存在することが見出され、おそらく癌幹細胞はそのような特権的な細胞種ではないことが示唆されている。
言い換えれば、癌幹細胞とは何か、さまざまな癌におけるその役割に関する考えが、変化していると思われる。
「ほとんどの癌で(幹細胞)モデルが適切に検証されていません」と、ミシガン大学幹細胞生物学センター長Dr. Sean Morrison氏は述べ、「癌幹細胞モデルに明らかに一致する癌がいくつかあると思います…しかし、これまで示されてきたものよりずっと複雑でしょう」と続けた。
進化するアイデア
ほとんどの癌細胞が腫瘍形成の能力を維持しているとする、癌研究では主流のランダムあるいは「確率」モデルと異なり、癌幹細胞モデルでは、階層的な仕組みによってあらかじめ配置され、元の腫瘍の全ての構成要素を包有する多能性癌幹細胞により腫瘍を形成する。
癌幹細胞がもつ多能性によってこれらの細胞が前駆細胞から分化していく際、化学療法、放射線療法、および最新の分子標的療法に対してさえも適応して抵抗性になるとも考えられ、それを支持するいくつかの実験的証拠がある。もしこれが正しければ、こうした治療法ではそのうちに癌幹細胞からの新しい前駆細胞の産生によって再発へ導かれることになり、こうした命を脅かす腫瘍細胞のほとんどを傷害できないとみられる。
過去16年間に、大腸癌、脳腫瘍、膵臓癌、乳癌などさまざまな癌の幹細胞を同定したという多くの研究が発表されたにもかかわらず、研究者らの統一見解では、癌源細胞集団が発見された最初の癌である急性骨髄性白血病(AML)および他の血液癌での証拠が最も強固であるとされている。
「血液悪性腫瘍でそれほど強固な証拠がある理由は、造血系の研究は40〜50年間の歴史があり、まさに幹細胞が基礎になっているからです」と、トロント大学の幹細胞研究者Dr. Jean Wang氏は述べた。「一方固形腫瘍では、正常細胞における階層制の同定および幹細胞と前駆細胞のような異なる細胞集団を同定する細胞表面マーカーについての基礎が少ないのです」。
たとえそうであったとしても、乳癌と脳腫瘍については癌幹細胞の存在がかなり立証されているとWang氏は確信している。しかし、「すべての癌に当てはまるかどうかはわかりません。多くの癌では当てはまるようです。しかし現在あるマーカーのほとんどは依然大まかなものです」と警告した。
癌幹細胞様の細胞が証明された癌種の数が増加しているものの、この学説には懐疑的な人々がおり、マウス異種移植試験の欠点や、癌幹細胞とそれ以外の癌細胞を区別するのに使用される細胞表面マーカーの特異性が変わりやすいことなどの問題を指摘する。
「未だ証明されていない概念だと感じています」と、最近NCIの癌研究センターの研究者らと共同でエストロゲン受容体陰性乳癌で癌幹細胞様細胞集団を同定した研究を発表したDr. Barbara Vonderhaar氏は述べた。「確実に素晴らしいアイデアですが、現時点では仮説にすぎません。癌幹細胞が存在する明確な証拠は依然ありません」。
癌幹細胞の概念は「過渡期の研究」と、ジョンズホプキンス大学医学部で血液癌における幹細胞の役割を研究する研究室を率いるDr. William Matsui氏は述べた。「理想的なモデルならば臨床にいる私たちにでもなんらかのヒトでの作用を発見できるものですが、それには遠く及びません」。
症例研究:メラノーマ
癌幹細胞の文献で最もよく知られる研究の一つが2008年にMorrison氏の研究室から発表されたものである。さらに初期の研究は、癌幹細胞モデル説と一致して、ヒトメラノーマ腫瘍を免疫不全マウス(NOD/SCIDマウス)に移植すると、ヒトメラノーマ腫瘍細胞由来の希少な細胞集団が存在し、それらが新たな腫瘍を形成することが示唆されていた。
Nature誌に発表された研究では、Morrison氏のチームは一般的な実験方法に手を加えた。すなわちNOD/SCIDマウスよりさらに免疫系に障害を受けたマウスを使用し、観察をさらに長期間継続した後で腫瘍増殖を評価した。その結果、ヒトメラノーマ試料から採取し、ランダムに選択した個々の細胞のうち約4分の1が腫瘍を形成することができたのであった。
この結果からは「腫瘍原性細胞(※腫瘍を作り出す細胞)の推定頻度はわれわれが考えていたよりはるかに試験方法に依存していることが明らかになりました」とMorrison氏は述べた。実験におけるマウスの免疫系の状態などの要因に加え、「おそらくまだ発見されていないものの中にも、かなり大きな影響を及ぼす他の変数があるでしょう」と続けた。(AMLでは、免疫不全の強いマウスを使用しても腫瘍形成能のある細胞数を有意に増加させないことに注意すべき)
スタンフォード大学の研究者らは今月Nature誌に、高度免疫不全のマウスにおいてメラノーマの形成が可能ないくらかの固有の細胞集団を同定するマーカーCD271を発見し、ヒト腫瘍試料中の2.5〜41%程度の細胞でこのマーカーが発現していたと報告した。ヒト皮膚を移植した類似のマウスを用いた追加実験で、マーカーをもつ腫瘍細胞のみがマウスで腫瘍を形成し転移した。(Morrison氏の研究室では、同マーカーが非腫瘍形成細胞と腫瘍形成細胞とを区別できなかったことを同氏は指摘した)
研究で使用した9人のヒトメラノーマ腫瘍由来のうち、かなり多くの割合の細胞が腫瘍化を開始したという事実は多くの事柄を反映すると、Nature誌論文の筆頭著者Dr. Alexander Boiko氏らは記述し、その中で、腫瘍への進行時に正常な分化を離れた腫瘍細胞がいき残るためにこうした漸進な様式が選択されたとした。
これは、癌幹細胞が必ずしも元の腫瘍に存在しなくとも、免疫系や低酸素との相互作用といったさまざまな因子や影響により、特定の腫瘍細胞(おそらくその多く)が幹細胞様「プログラム」を活性化できることを意味しているのかもしれない。
「微小環境すなわち幹細胞の「ニッチ」が細胞そのものと同様に重要であると固く信じています」とVonderhaar氏は述べた。「どの細胞でも癌幹細胞になれるのかはわかりませんが、細胞の階層制があり、一部は幹細胞様の様式で機能することができ、他はそうでないのでしょう」。
細胞自身が腫瘍を増殖できるかどうかの答えを出せるよう、癌幹細胞研究分野が早く到達する必要があることをMatsui氏は指摘し、「そして、臨床転帰に応用できる可能性のある他の特徴—薬剤抵抗性や転移の問題における役割など—は何かを問えるようにならなければなりません」と述べた。
癌幹細胞にまつわる一部の議論は「よいことです」と、Matsui氏は述べ、「それによりわれわれの仕事がより熾烈(しれつ)になるからです。研究が熾烈になるほど、すべてのアイデアが臨床に応用できるものになります」。
—Carmen Phillips
| 癌幹細胞研究のツール:マーカーおよび異種移植癌幹細胞とみられる細胞(癌幹細胞候補)を同定するのに使用できるいくつかの実験があるが、免疫不全マウスを用いたin vivoの機能実験が「ゴールドスタンダード(標準)」試験だと、Wang氏は述べた。癌幹細胞候補を同定するのに使用されるマーカーの多くは「正常システムの研究」からもたらされると、Matsui氏は説明する。例えば脳腫瘍では、初期の研究は正常な神経幹細胞のマーカーとして同定されていた細胞表面タンパク質CD133に焦点が当てられた。CD133は、脳腫瘍に加え大腸癌における癌幹細胞候補の同定にも用いられ、一方CD44は乳癌幹細胞の同定に、アルデヒドデヒドロゲナーゼ(ALDH)は他のマーカーと併用して、乳癌、前立腺癌、膵臓癌の幹細胞の同定に用いられている。 研究者らは興味のある単一または複数のマーカーを同定し、ヒト腫瘍試料を採取し、マーカーの存在の有無に基づきそれらを互いに分離する。 マウスの各部位に細胞を接種し、潜在的腫瘍原性細胞すなわち幹細胞マーカー候補を有する細胞を接種されたマウスでは腫瘍が発生し、非腫瘍原性細胞を接種されたマウスには腫瘍が発生しないかどうかを観察する。最初の実験で予想された腫瘍発生が認められれば、さらに癌幹細胞候補の「継代」を行う。このときはマウス腫瘍から分離した癌幹細胞候補を他のマウスに注射してより確実にマーカー結合細胞の腫瘍形成能を立証する。 特定の腫瘍を発生するように遺伝子操作されたマウスやゼブラフィッシュモデルなど、他の動物モデルでも試されている。 |
******
榎 真由 訳
高山 吉永(分子生物学/北里大学医学部分子遺伝学・助教)監修
******
【免責事項】
当サイトの記事は情報提供を目的として掲載しています。
翻訳内容や治療を特定の人に推奨または保証するものではありません。
ボランティア翻訳ならびに自動翻訳による誤訳により発生した結果について一切責任はとれません。
ご自身の疾患に適用されるかどうかは必ず主治医にご相談ください。
がん研究に関連する記事
ヒトパピローマウイルス(HPV)とがんの知られざるリスクと俗説
2025年3月17日
がん悪性度を予測する新たなバイオマーカーを発見
2025年2月25日
AIモデルが制御ゲノムの汎用「言語」を学習し、細胞のストーリーを予測
2025年2月10日
掲載誌: Cell Genomics誌、2025年1月29日
著者(ダナファーバーが...
欧州臨床腫瘍学会(ESMOアジア2024)ハイライト
2024年12月20日